|
|
Konsep Partikel Materi
Semua materi yang ada di sekeliling kita tersusun dari bagian yang sangat kecil yang disebut partikel. Pensil dan buku yang kita pegang, kursi dan meja yang kita gunakan, juga rambut kita semuanya tersusun dari partikel. Partikel ini berukuran sangat kecil, sehingga tidak memungkinkan bagi kita memegangnya juga untuk melihatnya secara langsung. Meskipun demikian, dengan menggunakan mikroskop elektron kita dapat melihat kumpulan partikel ini. Gambar berikut memperlihatkan gambar jarum dan benangnya menggunakan mikroskop elektron.
Gambar Pembelajaran Partikel Suatu Materi (Objek)
 Gambar a diatas adalah gambar jarum yang biasa kita lihat. Jika dilihat dengan menggunakan mikroskop elektron dengan pembesaran 130 kali kita akan lihat Gambar b diatas. Nampak bahwa sebenarnya permukaan jarum dan benang tidak sehalus yang kita lihat dengan mata secara langsung. Dengan pembesaran 60.000 kali kita akan lihat Gambar c diatas yang memperlihatkan bagaimana jarum tersusun dari kumpulan partikel.
Sekolah kita tentu saja belum memiliki mikroskop elektron. Tetapi kita tidak perlu berkecil hati, kita tetap dapat membuktikan keberadaan partikel penyusun materi dengan cara lain seperti yang akan kita pelajari dalam bagian berikut.
Siapkanlah selembar kertas putih. Buatlah titik-titik kecil dengan spidol hitam dengan jarak antar sesamanya kira-kira 1 mm dan tersebar pada luas sekitar 5 x 5 cm2. Buatlah titik-titik tersebut mengikuti suatu pola yang sama. Tempelkan kertas tersebut pada papan tulis dan pandanglah gambar titiktitik tersebut dari jarak dekat hingga kita dapat melihat titik-titiknya dengan jelas dan sampai jarak tertentu hingga kita hanya melihat warna kelabu saja.
Gambar a diatas adalah gambar jarum yang biasa kita lihat. Jika dilihat dengan menggunakan mikroskop elektron dengan pembesaran 130 kali kita akan lihat Gambar b diatas. Nampak bahwa sebenarnya permukaan jarum dan benang tidak sehalus yang kita lihat dengan mata secara langsung. Dengan pembesaran 60.000 kali kita akan lihat Gambar c diatas yang memperlihatkan bagaimana jarum tersusun dari kumpulan partikel.
Sekolah kita tentu saja belum memiliki mikroskop elektron. Tetapi kita tidak perlu berkecil hati, kita tetap dapat membuktikan keberadaan partikel penyusun materi dengan cara lain seperti yang akan kita pelajari dalam bagian berikut.
Siapkanlah selembar kertas putih. Buatlah titik-titik kecil dengan spidol hitam dengan jarak antar sesamanya kira-kira 1 mm dan tersebar pada luas sekitar 5 x 5 cm2. Buatlah titik-titik tersebut mengikuti suatu pola yang sama. Tempelkan kertas tersebut pada papan tulis dan pandanglah gambar titiktitik tersebut dari jarak dekat hingga kita dapat melihat titik-titiknya dengan jelas dan sampai jarak tertentu hingga kita hanya melihat warna kelabu saja.
Atom, Model Atom
Atom adalah bagian terkecil dari suatu unsur. Keadaan atom sesungguhnya sangat sukar untuk diungkapkan dalam bentuk gambar. Semua materi dapat dibagi-bagi sampai pada bagian yang terkecil dari zat tersebut sehingga tidak bisa dibagi-bagi lagi. Pada gambar dibawah diperlihatkan gambaran kasar tentang atom yang disimpulkan para ahli.

Atom
Menurut Aristoteles, pembagian materi bersifat kontinu. Suatu materi dapat dibagi menjadi bagian yang lebih kecil secara terus menerus tanpa ada batasnya. Sedangkan, Democritus berpendapat bahwa pembagian materi sifatnya diskontinu. Artinya, jika suatu materi dibagi secara terus menerus, maka akan diperoleh bagian yang terkecil dan tidak dapat dibagi lagi. Bagian itulah yang disebut dengan atom.
Pada 2500 tahun yang lalu, para ilmuan Yunani Kuno menyatakan bahwa materi terdiri dari bagian-bagian yang sangat kecil, disebut atom. Kata atom berasal dari kata atomos yang berarti tidak dapat dibagi-bagi lagi. Pendapat ini dikembangkan oleh Democritus dan dapat bertahan lama sekali, walaupun para ilmuan pada zaman itu belum bisa menjelaskan peristiwa-peristiwa perubahan zat yang terjadi di alam.
Model Atom
Istilah atom pertama kali diajukan oleh Anaxagoras. Democritus hanya mengungkapkan bahwa atom sangat kecil sehingga tidak dapat dibagi-bagi lagi. Pendapat tentang atom disempurnakan oleh John Dalton pada 1803. John Dalton (1766 – 1844) menyusun teori tentang atom yang lebih lengkap, yaitu sebagai berikut :
a.Materi terdiri atas sejumlah partikel yang sangat kecil dan tidak dapat
dipecah-pecah lagi. Partikel inilah yang dinamakan atom.
b.Atom-atom dalam suatu unsur identik dalam segala hal atau mempunyai sifat dan
massa yang sama dengan unsur tersebut, tetapi berbeda dengan atom-atom unsur
lain.
c.Atom dapat bergabung dengan atom lain membentuk suatu senyawa dengan
perbandingan tertentu yang nilainya bulat dan sederhana.
 Atom-atom unsur H berbeda dengan atom-atom unsur C
Atom unsur H memiliki kesamaan dalam segala hal (sifat dan massa) dengan atom unsur H yang lainnya, tetapi atom unsur H berbeda dengan atom unsur C.
Atom-atom unsur H berbeda dengan atom-atom unsur C
Atom unsur H memiliki kesamaan dalam segala hal (sifat dan massa) dengan atom unsur H yang lainnya, tetapi atom unsur H berbeda dengan atom unsur C.
 Atom-atom H bergabung dengan atom-atom O membentuk senyawa H2O
Atom H bergabung dengan atom O membentuk suatu senyawa. Perbandingan atom H dengan atom O dalam senyawa tersebut adalah 2 : 1.
Atom-atom H bergabung dengan atom-atom O membentuk senyawa H2O
Atom H bergabung dengan atom O membentuk suatu senyawa. Perbandingan atom H dengan atom O dalam senyawa tersebut adalah 2 : 1.
Model Atom J.J Thomson
Bila John Dalton mengemukakan teorinya seperti di atas, bahwa atom tidak dapat dibagi lagi, ternyata bertentangan dengan eksperimen-eksperimen.
 Model atom J.J. Thomson
Partikel-partikel yang lebih kecil, yang membentuk atom-atom sekarang banyak kita kenal. Sehubungan dengan penemuan elektron yang menjadi bagian dari atom maka J.J. Thomson menyarankan untuk pertama kali suatu model atom.
Model atom J.J. Thomson
Partikel-partikel yang lebih kecil, yang membentuk atom-atom sekarang banyak kita kenal. Sehubungan dengan penemuan elektron yang menjadi bagian dari atom maka J.J. Thomson menyarankan untuk pertama kali suatu model atom.
Teori atom menurut J.J. Thomson.
1) Atom berbentuk bola pejal yang bermuatan positif dan mengandung sejumlah elektron bermuatan negatif yang tersebar di seluruh zat atom.
2) Jumlah muatan positif dalam atom sama dengan jumlah muatan negatif elektron sehingga secara keseluruhan muatan atom adalah netral.
Model atom ini tidak dikembangkan secara terperinci, karena ternyata tidak cocok dengan percobaan-percobaan Rutherford.
Model Atom Rutherford
Ernest Rutherford pada tahun 1911 mengemukakan teorinya tentang susunan atom. Untuk membuktikan teorinya di dalam laboratorium Rutherford, Geoger, dan Marsder mengadakan suatu percobaan dengan menembakkan partikel-partikel alpa pada suatu lempengan emas yang sangat tipis, yaitu setebal 0,01 mm atau kira-kira setebal 200 atom. Apabila model atom Thomson itu benar, maka partikel-partikel alpa tidak akan dihamburkan pada saat mengenai lempengan emas.
Partikel alpa dengan energi yang sangat besar dan massa elektron diharapkan akan bergerak lurus, tak terganggu oleh elektron dan muatan positif atom emas yang menyebar di sekitar elektron.
 Percobaan Rutherford menggunakan partikel alfa
Ternyata partikel-partikel alpa yang digunakan dalam percobaan itu tidak seluruhnya dapat menembus lempengan emas secara lurus, tetapi beberapa di antaranya ada yang dibelokkan, bahkan ada yang dikembalikan dengan membentuk sudut antara 90o sampai 120o. Hal ini menunjukkan bahwa muatan positif dari atom tidak menyebar, tetapi mengumpul pada suatu tempat dalam tiap-tiap atom, sehingga dapat menghamburkan partikel-partikel alpa pada saat menumbuk atom-atom tersebut. Percobaan inilah yang mendorong Rutherford pada tahun 1911 untuk menyusun model atom yang baru.
Menurut Rutherford, Atom tersusun dari inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif bergerak mengelilingi inti tersebut
Percobaan Rutherford menggunakan partikel alfa
Ternyata partikel-partikel alpa yang digunakan dalam percobaan itu tidak seluruhnya dapat menembus lempengan emas secara lurus, tetapi beberapa di antaranya ada yang dibelokkan, bahkan ada yang dikembalikan dengan membentuk sudut antara 90o sampai 120o. Hal ini menunjukkan bahwa muatan positif dari atom tidak menyebar, tetapi mengumpul pada suatu tempat dalam tiap-tiap atom, sehingga dapat menghamburkan partikel-partikel alpa pada saat menumbuk atom-atom tersebut. Percobaan inilah yang mendorong Rutherford pada tahun 1911 untuk menyusun model atom yang baru.
Menurut Rutherford, Atom tersusun dari inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif bergerak mengelilingi inti tersebut
 Model atom Rutherford
Model atom Rutherford
Model Atom Bohr
Niels Bohr menyusun model atom berdasarkan model atom Rutherford dan teori kuantum. Model atom Bohr berdasarkan postulat-postulat berikut.
1. Elektron tidak dapat berputar mengelilingi inti pada setiap lintasan, tetapi
hanya melalui lintasan tertentu tanpa membebaskan energi. Lintasan ini disebut
lintasan stasioner.
2.Jika elektron berpindah dari salah satu lintasan ke lintasan lain yang
terhadapnya lebih dalam, akan dipancarkan energi dan bila berpindah ke lintasan
yang letaknya lebih luar, akan diserap energi.
Model atom Bohr digambarkan sebagai berikut.
 Model atom Bohr
Kelebihan atom Bohr adalah bahwa atom terdiri atas beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan model atom ini adalah tidak dapat menjelaskan spektrum warna dari atom berelektron banyak. Dengan demikian diperlukan model
atom yang lebih sempurna dari model atom Bohr.
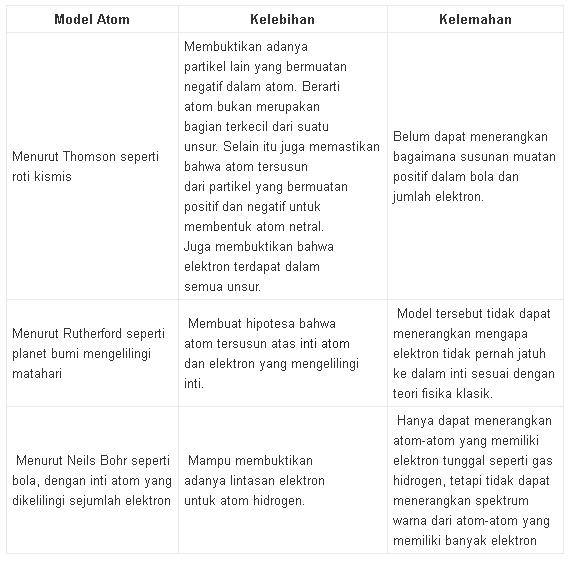
Berdasarkan uraian di atas ternyata masingmasing model atom mempunyai kelebihan dan kelemahan.
Model atom Bohr
Kelebihan atom Bohr adalah bahwa atom terdiri atas beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan model atom ini adalah tidak dapat menjelaskan spektrum warna dari atom berelektron banyak. Dengan demikian diperlukan model
atom yang lebih sempurna dari model atom Bohr.
Berdasarkan uraian di atas ternyata masingmasing model atom mempunyai kelebihan dan kelemahan.
Kelebihan dan Kelemahan model atom
Lambang Atom
Sebuah atom dapat dituliskan dalam lambang tertentu. Aturan penulisan lambang sebuah atom adalah sebagai berikut :
 dimana :
X = Lambang unsur yang disusun oleh atom
A = Nomor massa atom
Z = Nomor atom
dimana :
X = Lambang unsur yang disusun oleh atom
A = Nomor massa atom
Z = Nomor atom
Momor Masa Atom
Nomor massa atom (A) menyatakan jumlah proton dan neutron di dalam inti atom, sedangkan nomor atom (Z) menyatakan jumlah proton di dalam inti atom. Nomor atom juga menyatakan jumlah elektron yang beredar mengelilingi inti atom. Bila jumlah neutron dalam inti dilambangkan dengan N, maka :
A = Z + N
Dimana :
A = Nomor Massa Atom = Proton + Neutron
Z = Nomor atom = Jumlah Proton = Jumlah Elektron
Atom memiliki sifat yang netral. Oleh karena itu, jumlah proton harus sama dengan jumlah elektron. Dengan demikian, nomor atom menunjukkan pula jumlah elektron yang ada dalam atom itu.
Nomor atom = Jumlah proton dalam inti atom
= Jumlah elektron dalam inti atom
Sebagai contoh, atom karbon memiliki nomor massa 12 dan nomor atom 6. Tentukan:
a. aturan penulisan dari atom karbon tersebut
b. jumlah proton
c. jumlah elektron
d. jumlah neutron
Jawab:
a. Aturan penulisan dari atom karbon adalah C karena atom karbon memiliki nomor massa (A) = 12 dan nomor atom (Z) = 6.
b. Jumlah proton (Z) = 6.
c. Jumlah elektron (Z) = 6.
d. Jumlah neutron = nomor massa (A) – nomor atom (Z) = 12 – 6 = 6
Nomor massa atom menunjukkan jumlah proton dan neutron di dalam inti atom, sedangkan nomor atom menunjukkan jumlah elektron yang beredar mengelilingi inti atom.
Ion
Ion merupakan atom atau gabungan beberapa atom yang mempunyai muatan listrik positif atau negatif. Atom atau kumpulan atom yang memiliki muatan listrik positif disebut ion positif atau kation. Sedangkan, yang bermuatan listrik negatif disebut ion negatif atau anion.
 Elektron yang mengelilingi inti atom terus bergerak sambil berputar pada sumbunya. Akan tetapi, elektron dapat meninggalkan atom karena sesuatu hal, seperti pemanasan, medan listrik, dan medan magnet. Elektron yang keluar dari suatu atom dapat masuk ke atom lainnya. Akibatnya, atom yang kehilangan elektron akan menjadi atom yang bermuatan listrik positif karena jumlah proton menjadi lebih besar daripada jumlah elektronnya, sedangkan atom yang kedatangan elektron menjadi atom bermuatan listrik negatif karena jumlah elektronnya melebihi jumlah protonnya.
Elektron yang mengelilingi inti atom terus bergerak sambil berputar pada sumbunya. Akan tetapi, elektron dapat meninggalkan atom karena sesuatu hal, seperti pemanasan, medan listrik, dan medan magnet. Elektron yang keluar dari suatu atom dapat masuk ke atom lainnya. Akibatnya, atom yang kehilangan elektron akan menjadi atom yang bermuatan listrik positif karena jumlah proton menjadi lebih besar daripada jumlah elektronnya, sedangkan atom yang kedatangan elektron menjadi atom bermuatan listrik negatif karena jumlah elektronnya melebihi jumlah protonnya.
Peristiwa Pada Ion
Peristiwa terurainya suatu zat menjadi ion–ion disebut ionisasi. Hasil ionisasi disebut ion. Elektron yang dapat keluar atau masuk ke suatu atom adalah elektron yang berada di kulit terluar. Ionisasi atom hanya terjadi pada atom-atom yang jumlah elektron paling luarnya tidak sama dengan 8, 18, atau 32. Atom-atom yang jumlah elektronnya sama dengan bilangan-bilangan tersebut sangat sulit terionisasi sehingga disebut unsur gas mulia.
Jumlah elektron yang terlepas atau masuk tergantung pada jumlah elektron pada kulit terluar dengan ketentuan sebagai berikut.
1.Jika jumlah elektron terluar kurang dari 4 elektron maka atom ini cenderung
melepaskan elektron;
2.jika jumlah elektron terluar antara 4 dan 8 maka atom ini cenderung menerima
elektron;
3.jumlah elektron yang diterima atau dilepaskan membuat jumlah elektron di kulit
itu menjadi 8;
4.jumlah elektron pada kulit terluar sama dengan 4 maka atom ini dapat melepas
atau menerima elektron, tergantung dengan unsur apa atom itu berinteraksi;
5.jumlah elektron pada kulit terluar sama dengan 8 maka atom itu sangat sukar
melepas maupun menerima elektron.
Ion Positif (Kation) Ion Negatif (Anion)
Beberapa contoh kation dan anion dapat kita lihat pada tabel berikut ini.
 Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik. Contoh yang paling sederhana adalah senyawa natrium klorida atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+ dan ion Cl- akan tarik-menarik membentuk suatu senyawa NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-.
Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik. Contoh yang paling sederhana adalah senyawa natrium klorida atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+ dan ion Cl- akan tarik-menarik membentuk suatu senyawa NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-.
Molekul
Molekul merupakan partikel terkecil dari suatu zat yang masih memiliki sifat-sifat zat tersebut. Molekul tersusun dari dua atom atau lebih. Molekul dapat tersusun dari atom-atom yang berbeda, tetapi dapat pula tersusun dari atom-atom yang sama. Molekul yang tersusun dari atom-atom yang berbeda dinamakan molekul senyawa, misalnya molekul air (H2O) dan molekul karbondioksida (CO2). Tiap satu molekul air tersusun dari satu atom oksigen dan dua atom hidrogen, setiap satu molekul karbondioksida mengandung satu atom karbon dan dua atom oksigen. Sebagai contoh dapat dilihat gambar contoh molekul senyawa pada gambar berikut.
Molekul Senyawa Air Dan Karbon Dioksida
 Molekul yang tersusun dari atom yang sama dinamakan molekul unsur, misalnya hidrogen (H2), oksigen (O2), nitrogen (N2), dan klorin (Cl2) . Tiap satu molekul oksigen tersusun dari dua atom oksigen. Gambar berikut merupakan contoh beberapa molekul unsur.
Molekul yang tersusun dari atom yang sama dinamakan molekul unsur, misalnya hidrogen (H2), oksigen (O2), nitrogen (N2), dan klorin (Cl2) . Tiap satu molekul oksigen tersusun dari dua atom oksigen. Gambar berikut merupakan contoh beberapa molekul unsur.
Molekul Unsur Hidrogen Dan Oksigen
 Untuk membuktikan keberadaan molekul, dapat dibuktikan dengan percobaan menggunakan gula dan air berikut. Gula tersusun dari partikel-partikel kecil yang menyebabkan rasa manis. Setelah gula tersebut masuk ke dalam air, maka gula akan larut dan partikel-partikel penyusunnya akan menyebar diantara partikel-partikel air. Karena kecilnya partikel-partikel ini tidak dapat disaring, bahkan tidak dapat dilihat langsung oleh mata kita. Meskipun berubah menjadi partikel dengan ukuran sangat kecil, rasa manis tidak hilang. Partikel terkecil gula yang masih memiliki sifat gula tersebut disebut molekul gula.
Untuk membuktikan keberadaan molekul, dapat dibuktikan dengan percobaan menggunakan gula dan air berikut. Gula tersusun dari partikel-partikel kecil yang menyebabkan rasa manis. Setelah gula tersebut masuk ke dalam air, maka gula akan larut dan partikel-partikel penyusunnya akan menyebar diantara partikel-partikel air. Karena kecilnya partikel-partikel ini tidak dapat disaring, bahkan tidak dapat dilihat langsung oleh mata kita. Meskipun berubah menjadi partikel dengan ukuran sangat kecil, rasa manis tidak hilang. Partikel terkecil gula yang masih memiliki sifat gula tersebut disebut molekul gula.
Hubungan Atom, Ion, Dan Molekul Dengan Produk Kimia
Hubungan atom, ion, dan molekul dengan produk kimia dapat kita temuai pada bakso. Bila kita membeli bakso, di depan kita sering tersaji berbagai macam sajian untuk menambah selera makan, misalnya garam dapur, saos, kecap, sambal, dan cuka. Garam dapur biasa digunakan untuk menambah rasa asin, sedang cuka digunakan untuk menambah rasa asam.
Hubungan Atom, Ion, Dan Molekul Dengan Produk Kimia (Bakso)
 Garam dapur yang dalam bahasa kimianya natrium klorida memiliki rumus NaCl. Garam dapur (NaCl) tersusun atas ion-ion, yaitu ion positif yang berasal dari natrium (Na+) dan ion klorida (Cl–) sebagai ion negatif.
Adapun pada cuka (Asam Asetat) memiliki rumus molekul CH3COOH. Asam asetat tersusun atas dua atom C (karbon), empat atom H (hidrogen), dan dua atom O (oksigen). Semua atom dalam asam asetat bersatu membentuk senyawa dengan perbandingan tertentu.
Kadang kita juga sering melihat tulisan dalam label cuka yaitu 25%. Hal ini menunjukkan bahwa dalam 100 mL larutan cuka, 25 mL adalah cuka dan 75 mL adalah pelarut/pengencer yang biasanya menggunakan air.
Garam dapur yang dalam bahasa kimianya natrium klorida memiliki rumus NaCl. Garam dapur (NaCl) tersusun atas ion-ion, yaitu ion positif yang berasal dari natrium (Na+) dan ion klorida (Cl–) sebagai ion negatif.
Adapun pada cuka (Asam Asetat) memiliki rumus molekul CH3COOH. Asam asetat tersusun atas dua atom C (karbon), empat atom H (hidrogen), dan dua atom O (oksigen). Semua atom dalam asam asetat bersatu membentuk senyawa dengan perbandingan tertentu.
Kadang kita juga sering melihat tulisan dalam label cuka yaitu 25%. Hal ini menunjukkan bahwa dalam 100 mL larutan cuka, 25 mL adalah cuka dan 75 mL adalah pelarut/pengencer yang biasanya menggunakan air.
Hubungan Atom, Ion, Dan Molekul Dengan Produk Kimia Sehari-hari
Banyak benda-benda di sekitar kita yang pengolahannya menggunakan reaksi kimia atau biasa disebut sebagai produk kimia. Pembuatan detergen, margarin, air murni, dan asam sulfat serta garam dapur adalah contoh pemanfaatan konsep atom, molekul dan ion pada produk kimia sehari-hari. Mari kita bahas satu persatu.
Pembuatan Detergen
 Oleh karena berkurangnya tanaman yang menghasilkan minyak sementara jumlah penduduk semakin banyak maka kebutuhan manusia akan sabun tidak tercukupi. Melalui kemajuan teknologi, ditemukanlah bahan pencuci sintetis, yaitu detergen. Ada dua jenis detergen sebagai berikut.
1.Detergen keras: sukar diuraikan oleh bakteri sehingga menimbulkan pencemaran lingkungan.
2. Detergen lunak: dapat diuraikan oleh bakteri sehingga tidak terlalu menimbulkan pencemaran.
Adapun bahan pembuat detergen adalah sebagai berikut.
Oleh karena berkurangnya tanaman yang menghasilkan minyak sementara jumlah penduduk semakin banyak maka kebutuhan manusia akan sabun tidak tercukupi. Melalui kemajuan teknologi, ditemukanlah bahan pencuci sintetis, yaitu detergen. Ada dua jenis detergen sebagai berikut.
1.Detergen keras: sukar diuraikan oleh bakteri sehingga menimbulkan pencemaran lingkungan.
2. Detergen lunak: dapat diuraikan oleh bakteri sehingga tidak terlalu menimbulkan pencemaran.
Adapun bahan pembuat detergen adalah sebagai berikut.
1. Bahan penurun tegangan permukaan
Bahan penurun tegangan permukaan digunakan untuk memudahkan mengikat kotoran dan menimbulkan busa, antara lain sebagain berikut.
a.Alkil Benzen Sulfonat (ABS) + NaOH menghasilkan Natrium Alkil Benzen Sufonat (detergen keras).
b.Lauril Asam Sulfat (LAS) + NaOH menghasilkan Natrium Lauril Sulfat (detergen lunak)
2. Bahan penunjang
Bahan penunjang pada detergen digunakan STPP (Sodium Tri Poli Phosphat/Natrium Tri Poli Phosphat) berfungsi menunjang kerja bahan penurun tegangan permukaan.
3. Bahan pengisi
Bahan pengisi detergen digunakan untuk memperbesar volume materi.
4. Bahan pengikat
Sebagai bahan pengikat digunakan air, yaitu untuk mencampurkan semua bahan (media).
5. Bahan tambahan
Sebagai bahan tambahan digunakan CMC (Carboxy Metyl Cellulose), agar kotoran yang terikat detergen tidak melekat kembali ke bahan yang dicuci.
6. Bahan pewangi dan pewarna
Bahan pewangi dan pewarna digunakan agar detergen mempunyai warna dan aroma yang spesifik untuk membedakan dengan merk lain dan sesuai dengan warna dan aroma yang diminati konsumen.
Semua bahan dicampur dan dapat dibentuk pasta (krim) atau disemprotkan lewat menara sehingga menghasilkan butiran-butiran.
Pembuatan Garam Dapur
Garam dapur digunakan oleh ibu-ibu bumbu masak. Garam dapur berasa asin, masakan yang kurang garam berasa hambar. Molekul garam dapur terdiri dari satu atom natrium (Na) yang bergabung dengan satu atau chlor (Cl) menjadi molekul NaCl.
 Pembuatan garam dapur dapat dilakukan dengan proses sebagai berikut.
1.Air laut masuk ke kolam/tambak penampungan air laut, saat terjadi pasang naik.
2.Air laut yang sudah masuk kolam, mengalami pemanasan oleh sinar matahari, sehingga didapat kristal-kristal garam dapur NaCl yang belum steril.
3.Kristal garam dapur diambil di proses di pabrik guna sterilisasi dan pembersihan.
Pembuatan deterjen dan garam dapur diatas merupakan penerapan dari hubungan atom, ion, dan molekul dengan produk kimia sehari-hari.
IPA SMP ONLINE © 2015 by Teguh Wirwan.All Rights Reserved
Pembuatan garam dapur dapat dilakukan dengan proses sebagai berikut.
1.Air laut masuk ke kolam/tambak penampungan air laut, saat terjadi pasang naik.
2.Air laut yang sudah masuk kolam, mengalami pemanasan oleh sinar matahari, sehingga didapat kristal-kristal garam dapur NaCl yang belum steril.
3.Kristal garam dapur diambil di proses di pabrik guna sterilisasi dan pembersihan.
Pembuatan deterjen dan garam dapur diatas merupakan penerapan dari hubungan atom, ion, dan molekul dengan produk kimia sehari-hari.
IPA SMP ONLINE © 2015 by Teguh Wirwan.All Rights Reserved
MATERI-----PELAJARAN
| |
 Gambar a diatas adalah gambar jarum yang biasa kita lihat. Jika dilihat dengan menggunakan mikroskop elektron dengan pembesaran 130 kali kita akan lihat Gambar b diatas. Nampak bahwa sebenarnya permukaan jarum dan benang tidak sehalus yang kita lihat dengan mata secara langsung. Dengan pembesaran 60.000 kali kita akan lihat Gambar c diatas yang memperlihatkan bagaimana jarum tersusun dari kumpulan partikel.
Sekolah kita tentu saja belum memiliki mikroskop elektron. Tetapi kita tidak perlu berkecil hati, kita tetap dapat membuktikan keberadaan partikel penyusun materi dengan cara lain seperti yang akan kita pelajari dalam bagian berikut.
Siapkanlah selembar kertas putih. Buatlah titik-titik kecil dengan spidol hitam dengan jarak antar sesamanya kira-kira 1 mm dan tersebar pada luas sekitar 5 x 5 cm2. Buatlah titik-titik tersebut mengikuti suatu pola yang sama. Tempelkan kertas tersebut pada papan tulis dan pandanglah gambar titiktitik tersebut dari jarak dekat hingga kita dapat melihat titik-titiknya dengan jelas dan sampai jarak tertentu hingga kita hanya melihat warna kelabu saja.
Gambar a diatas adalah gambar jarum yang biasa kita lihat. Jika dilihat dengan menggunakan mikroskop elektron dengan pembesaran 130 kali kita akan lihat Gambar b diatas. Nampak bahwa sebenarnya permukaan jarum dan benang tidak sehalus yang kita lihat dengan mata secara langsung. Dengan pembesaran 60.000 kali kita akan lihat Gambar c diatas yang memperlihatkan bagaimana jarum tersusun dari kumpulan partikel.
Sekolah kita tentu saja belum memiliki mikroskop elektron. Tetapi kita tidak perlu berkecil hati, kita tetap dapat membuktikan keberadaan partikel penyusun materi dengan cara lain seperti yang akan kita pelajari dalam bagian berikut.
Siapkanlah selembar kertas putih. Buatlah titik-titik kecil dengan spidol hitam dengan jarak antar sesamanya kira-kira 1 mm dan tersebar pada luas sekitar 5 x 5 cm2. Buatlah titik-titik tersebut mengikuti suatu pola yang sama. Tempelkan kertas tersebut pada papan tulis dan pandanglah gambar titiktitik tersebut dari jarak dekat hingga kita dapat melihat titik-titiknya dengan jelas dan sampai jarak tertentu hingga kita hanya melihat warna kelabu saja.

 Atom-atom unsur H berbeda dengan atom-atom unsur C
Atom unsur H memiliki kesamaan dalam segala hal (sifat dan massa) dengan atom unsur H yang lainnya, tetapi atom unsur H berbeda dengan atom unsur C.
Atom-atom unsur H berbeda dengan atom-atom unsur C
Atom unsur H memiliki kesamaan dalam segala hal (sifat dan massa) dengan atom unsur H yang lainnya, tetapi atom unsur H berbeda dengan atom unsur C.
 Atom-atom H bergabung dengan atom-atom O membentuk senyawa H2O
Atom H bergabung dengan atom O membentuk suatu senyawa. Perbandingan atom H dengan atom O dalam senyawa tersebut adalah 2 : 1.
Atom-atom H bergabung dengan atom-atom O membentuk senyawa H2O
Atom H bergabung dengan atom O membentuk suatu senyawa. Perbandingan atom H dengan atom O dalam senyawa tersebut adalah 2 : 1.
 Model atom J.J. Thomson
Partikel-partikel yang lebih kecil, yang membentuk atom-atom sekarang banyak kita kenal. Sehubungan dengan penemuan elektron yang menjadi bagian dari atom maka J.J. Thomson menyarankan untuk pertama kali suatu model atom.
Model atom J.J. Thomson
Partikel-partikel yang lebih kecil, yang membentuk atom-atom sekarang banyak kita kenal. Sehubungan dengan penemuan elektron yang menjadi bagian dari atom maka J.J. Thomson menyarankan untuk pertama kali suatu model atom.
 Percobaan Rutherford menggunakan partikel alfa
Ternyata partikel-partikel alpa yang digunakan dalam percobaan itu tidak seluruhnya dapat menembus lempengan emas secara lurus, tetapi beberapa di antaranya ada yang dibelokkan, bahkan ada yang dikembalikan dengan membentuk sudut antara 90o sampai 120o. Hal ini menunjukkan bahwa muatan positif dari atom tidak menyebar, tetapi mengumpul pada suatu tempat dalam tiap-tiap atom, sehingga dapat menghamburkan partikel-partikel alpa pada saat menumbuk atom-atom tersebut. Percobaan inilah yang mendorong Rutherford pada tahun 1911 untuk menyusun model atom yang baru.
Menurut Rutherford, Atom tersusun dari inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif bergerak mengelilingi inti tersebut
Percobaan Rutherford menggunakan partikel alfa
Ternyata partikel-partikel alpa yang digunakan dalam percobaan itu tidak seluruhnya dapat menembus lempengan emas secara lurus, tetapi beberapa di antaranya ada yang dibelokkan, bahkan ada yang dikembalikan dengan membentuk sudut antara 90o sampai 120o. Hal ini menunjukkan bahwa muatan positif dari atom tidak menyebar, tetapi mengumpul pada suatu tempat dalam tiap-tiap atom, sehingga dapat menghamburkan partikel-partikel alpa pada saat menumbuk atom-atom tersebut. Percobaan inilah yang mendorong Rutherford pada tahun 1911 untuk menyusun model atom yang baru.
Menurut Rutherford, Atom tersusun dari inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif bergerak mengelilingi inti tersebut
 Model atom Rutherford
Model atom Rutherford
 Model atom Bohr
Kelebihan atom Bohr adalah bahwa atom terdiri atas beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan model atom ini adalah tidak dapat menjelaskan spektrum warna dari atom berelektron banyak. Dengan demikian diperlukan model
atom yang lebih sempurna dari model atom Bohr.
Berdasarkan uraian di atas ternyata masingmasing model atom mempunyai kelebihan dan kelemahan.
Model atom Bohr
Kelebihan atom Bohr adalah bahwa atom terdiri atas beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan model atom ini adalah tidak dapat menjelaskan spektrum warna dari atom berelektron banyak. Dengan demikian diperlukan model
atom yang lebih sempurna dari model atom Bohr.
Berdasarkan uraian di atas ternyata masingmasing model atom mempunyai kelebihan dan kelemahan.

 dimana :
X = Lambang unsur yang disusun oleh atom
A = Nomor massa atom
Z = Nomor atom
dimana :
X = Lambang unsur yang disusun oleh atom
A = Nomor massa atom
Z = Nomor atom

 Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik. Contoh yang paling sederhana adalah senyawa natrium klorida atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+ dan ion Cl- akan tarik-menarik membentuk suatu senyawa NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-.
Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik. Contoh yang paling sederhana adalah senyawa natrium klorida atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+ dan ion Cl- akan tarik-menarik membentuk suatu senyawa NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-.


 Garam dapur yang dalam bahasa kimianya natrium klorida memiliki rumus NaCl. Garam dapur (NaCl) tersusun atas ion-ion, yaitu ion positif yang berasal dari natrium (Na+) dan ion klorida (Cl–) sebagai ion negatif.
Adapun pada cuka (Asam Asetat) memiliki rumus molekul CH3COOH. Asam asetat tersusun atas dua atom C (karbon), empat atom H (hidrogen), dan dua atom O (oksigen). Semua atom dalam asam asetat bersatu membentuk senyawa dengan perbandingan tertentu.
Kadang kita juga sering melihat tulisan dalam label cuka yaitu 25%. Hal ini menunjukkan bahwa dalam 100 mL larutan cuka, 25 mL adalah cuka dan 75 mL adalah pelarut/pengencer yang biasanya menggunakan air.
Garam dapur yang dalam bahasa kimianya natrium klorida memiliki rumus NaCl. Garam dapur (NaCl) tersusun atas ion-ion, yaitu ion positif yang berasal dari natrium (Na+) dan ion klorida (Cl–) sebagai ion negatif.
Adapun pada cuka (Asam Asetat) memiliki rumus molekul CH3COOH. Asam asetat tersusun atas dua atom C (karbon), empat atom H (hidrogen), dan dua atom O (oksigen). Semua atom dalam asam asetat bersatu membentuk senyawa dengan perbandingan tertentu.
Kadang kita juga sering melihat tulisan dalam label cuka yaitu 25%. Hal ini menunjukkan bahwa dalam 100 mL larutan cuka, 25 mL adalah cuka dan 75 mL adalah pelarut/pengencer yang biasanya menggunakan air.